obr. 1
Nervové a svalové buňky, podobné jako jiné buňky živého organismu, jsou ohraničeny lipoproteinovou membránou, která je dobrým elektrickým izolátorem. Na obou stranách membrány obvykle existuje elektrický rozdíl potenciálů - membránový potenciál, který ovlivňuje proces látkové výměny. U teplokrevných živočichů leží mezi -50 mV až -100 mV, s výjimkou buněk hladkých svalů, které mají klidový potenciál kolem - 30 mV. Rozložení elektrických nábojů v blízkém okolí buněčné membrány souvisí s převahou sodíkových iontů vně buňky a draselných iontů uvnitř, neboť membránou procházejí snadněji ionty K+ a Cl-, nesnadno Na+. Proto jsou na zevním povrchu membrány kladné náboje, na jejím vnitřním povrchu záporné náboje. Pro měření membránového potenciálu se používá mikroelektroda - skleněná kapilára vytažená tak, aby se vytvořil velmi úzký kroužek, s průměrem menším než 1 um, která je vyplněná roztokem s dobrou elektrickou vodivostí. Existuje metoda s jejíž pomocí lze měřit proudy tekoucí buněčnou membránou o velikosti kolem 1 pA. Pomocí kanyly o tloušťce tisíciny milimetru je tak možné sledovat jednotlivé kanály, jimiž se v buněčné membráně transportují pozitivně nabité ionty sodíku z buňky. Referenční elektroda ve vnějším prostředí buňky je obvykle destička Ag-AgCl. Klidový potenciál nervové a svalové buňky je vždy záporný, - pól uvnitř buňky, + pól na vnějším povrchu membrány.
Aby bylo vnitřní prostředí buňky mnohem zápornější než povrch membrány, tak musí být uvnitř buňky nadbytečný záporný náboj tvořený anionty. Poněvadž tloušťka izolující buněčné membrány je kolem 6 um, pak k vytvoření klidového potenciálu -90 mV je zapotřebí v elementárním objemu 1um x 1um x 0,001 um následujícího počtu iontů. V extracelulárním prostředí přibližné 100 000 iontů Na+, zde bývá jejich koncentrace 5 až 15 krát vyšší v porovnání s koncentrací v intracelulárním prostředí. Dále se na vytvoření elektrochemického potenciálu podílí rozdělení iontů draslíku K+ a chloru Cl-. V nervových a svalových buňkách je koncentrace iontů draslíku K+ 20 - 100 krát vyšší než jejich vnější koncentrace. Koncentrace iontů chloru Cl- je přibližně inverzní rozdělení iontů draslíku, uvnitř buňky je v elementárním objemu 2200 iontů Cl-, vně buňky 110 000 iontů Cl-. V důsledku rozdílné koncentrace iontů na obou stranách buněčné membrány mají ionty tendenci pronikat do nitra buňky nebo ven souhlasně se svým koncentračním gradientem. Když by například ionty sodíku nebyly vypuzované z buňky ven, proti svému elektrochemickému gradientu, aktivním metabolickým mechanismem, jejich vstupování by s ohledem na jejich kladný náboj vyvolalo v krátkém období vyrovnání potenciálového rozdílu na obou stranách membrány. Došlo by tudíž k depolarizaci. Metabolickým, energii spotřebujícím procesem, se stále pumpují ionty sodíku z buňky a současně vlivem koncentračního gradientu dochází k difůzi iontů draslíku z buňky. Tento mechanismus se obvykle nazývá sodíko-draslíková pumpa.
Dráždíme-li elektricky nerv, vyvolá se nervový vzruch. Jeho šíření podél axonu je provázeno akčním potenciálem. Akční potenciál je rychlá změna membránového potenciálu do pozitivního smyslu. V důsledku stimulace vylučuje nerv acetylcholin. Jakmile molekula této látky ulpí v některém z iontových kanálů buněčné membrány, ten se otevře a uvolní cestu iontům. Jedny ionty vstupují do buňky, druhé ji opouští. Jestliže depolarizace baňky je dostatečné vyjádřená, vzniká akční potenciál. Výsledkem depolarizační stimulace je lokální změna potenciálového rozdílu na buněčné membráně. některé synapse předávají tento vzruch, některé útlum projevující se vznikem hyperpolarizace - je to v závislosti na tom, které iontové kanály regulují.
Vstup kladně nabitých iontů sodíku do buňky vyvolává depolarizaci, proto synapse kontrolující sodíkové kanály jsou excitovány. Naopak, jsou-li otevřeny kanály draslíku, ačkoliv ionty K+ také nesou pozitivní náboj, buňka se hyperpolarizuje, neboť ionty K+ buňku opouští. Proto synapse kontrolující draslíkové kanály jsou tlumící. Jedna a tatáž nervová buňka může přijímat excitační i tlumící signály současně. Výsledkem je v určitém časovém období depolarizace, někdy však dochází k hyperpolarizaci. Výsledkem opačných procesů je, že v této oblasti se lokálně porušuje klidový potenciál a tak dochází ke vzniku akčního potenciálu. Tento je projevem elektrické aktivity neuronů, kosterní svalů, myokardu a hladkých svalů trávicího ústrojí. V iontových kanálech působí také některé léky - jimi pronikají do jádra buňky, kde se jejich účinek teprve plné rozvine.

obr. 1
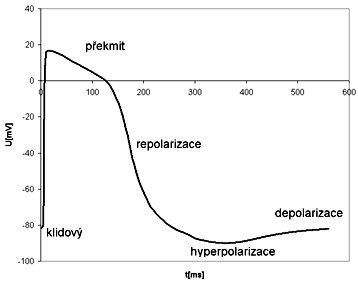
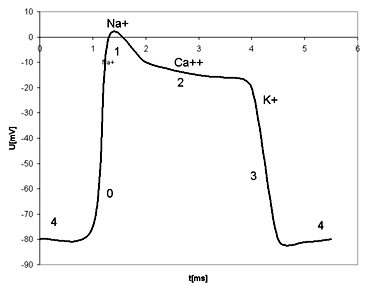
Smysl toku různých druhů iontů iontovými kanály je určen jednak silami vytvořenými gradienty jejich koncentrací, jednak exogenními vlivy. Na obr. 1 je uveden příklad akčního potenciálu, kde potenciál strmě narůstá ze záporných hodnot klidového potenciálu do pozitivního hrotu s vrcholovou amplitudou kolem +20 mV. Depolarizace znamená zvyšování vnitřního potenciálu buňky do kladných hodnot. Pak se potenciál vrací k výchozí úrovni klidového potenciálu. Stává-li se vnitřek buňky zápornější než v období klidu - jedná se o hyperpolarizaci. Trvání akčního potenciálu je nejkratší v nervech kolem l ms, v kosterních svalech je řádové 10 ms, ještě delší je v myokardu (i přes 200 ms), nejdelší v hladkých svalech (i několik sekund). Základní membránové děje jsou schematicky znázorněny na obr. 2. Ve fázi O je propustnost pro sodíkové ionty určována funkcí rychlého sodíkového kanálu. Tento kanál je otevírán asi při napětí 75 mV. Buněčnou membránou se pasivně a aktivně přemisťují ionty Na+, Ca2+, K+ - přičemž velikosti těchto iontových proudů jsou v každém okamžiku závislé na tloušťce kanálu a existujícím elektrochemickém potenciálovém rozdílu na buněčné membráně. Ve fázi 2 se k pronikajícím sodíkovým iontům pomalým sodíkovým kanálem přidávají ionty vápníku. Při poklesu napětí na buněčné membráně asi na 45 mV se uvádí do činnosti "pomalý" draslíkový kanál, jímž tečou ionty draslíku z buňky ven, a který zůstává v činnosti po celé období repolarizace.
obr. 2
V průběhu akčního potenciálu existuje několik fází (obr. 1): Ve fázi narůstaní , neboli depolarizace, která trvá velmi krátce, ztrácí buněčná membrána svoji normální polarizaci. Depolarizace způsobuje podráždění, které náhle zvýší propustnost pro sodíkové ionty, které rychle pronikají do nitra buňky sodíkovým kanálem a tím depolarizují buněčnou membránu stále víc. Důsledkem tohoto transportu Na+ iontů se membránový potenciál invertuje a asymptoticky blíží k hodnotě, při které se dosáhne rovnováhy iontů sodíku na obou stranách membrány. Pak jsou splněny podmínky ke vzniku průtoku draselných iontů z buňky ven. Když proud iontů vápníku převáží nad proudem iontů sodíku, začne repolarizace membrány, během které se membránový potenciál vrací ke své klidové hodnotě.
U nervových buněk za přibližně 1 ms po dosažení klidového potenciálu nastává zřetelný podkmit repolarizační křivky obr. 1, za nímž následuje pomalá změna potenciálu ke klidové úrovni. Výrazný podkmit vykazuji např. neurony míchy.
Elektrický akční potenciál se objevuje nejen v místě dráždění, ale i ve značných vzdálenostech od něho, řádově 1 m. Na celé délce nervového vlákna mají potenciály stejnou amplitudu, ale objevují se s jistým zpožděním úměrným vzdáleností od místa podráždění.
Periferní nervy se skládají z velkého množství nervových vláken ,většinou jsou opatřeny myelinovou pochvou, i když některá jsou bez ní, např. vlákna senzitivní. Vlákna se liší též průměrem a tloušťkou myelinové pochvy a mají různou rychlost vedení vzruchu, silně závislou právě na tloušťce myelinového obalu, jak je patrné z následující tabulky.
| typ vlákna | funkce | průměr [um] | rychlost [m/s] |
| A-alfa | motorické a aferentní vlákna svalových vřetének | 15 | 100 |
| A-beta | kožní aferentní vlákna | 8 | 50 |
| A-gama | eferentní vlákna svalových vřetének | 5 | 20 |
| A-delta | kožní aferentní vlákna mechanoreceptorů a nociceptorů | 2 | 15 |
| B | pregangliová vlákna | 3 | 7 |
| C | kožní aferentní nociceptorů | 1 | 1 |
Další možností generování elektrického pole buňkou by mohla být snaha buněk přitáhnout do svého okolí a následně navázat na svůj povrch co největší množství energeticky vydatných látek. Jedním z hlavních zdrojů energie většiny buněk je adenozin-trifosfát ATP, buňky z něj získávají energii odštěpováním iontů PO3-. Nejprve dochází k rozkladu na adenozin-difosfát a dále může dojít až k rozštěpení na adenozin-monofosfát za vzniku poměrně velkého množství energie.
ATP je složena z adeninové báze, na níž je navázán cukr a společně tvoří adenozin. Na adenozin je pak navázán trifosfát, z nějž se případně jednotlivé fosfátové skupiny oddělují. Díky této struktuře vytváří celá molekula ATP takzvanou dielektrickou partikuli, která se vyznačuje tím, že každá část podlouhlé molekuly má jinou permitivitu. Ačkoliv molekula sama bez přítomnosti elektrického pole nevykazuje dipólový moment, po vložení do homogenního elektrického pole dojde vlivem nestejné permitivity k vytvoření nábojů na protilehlých koncích molekula a natočení do směru pole. Ještě více je tento jev patrný v nehomogenním elektrickém poli, kdy dojde v důsledku silového působení dielektrického potenciálu a nehomogenního pole k pohybu partikule směrem ke zdroji pole.
Popsaný jev je obecně označován jako dielektroforéza a v současné době je zkoumán poměr partikulí přitažených k povrchu vůči partikulím rovnoměrně rozptýleným v okolí buňky a je sledována významnost tohoto poměru. Další podporou této myšlenky by mohlo být i to, že proteiny vykazují statické rozložení náboje, elektrický dipól jako důsledek přítomnosti aminokyselin.
Jedním z dalších možných zdrojů elektromagnetického pole v buňkách by mohl být nosný systém buňky zvaný cytoskelet neboli buněčná kostra. Cytoskelet je možné si představit jako dynamickou soustavu vláken, jež se mění podle vlivů prostředí nebo potřeb buňky. Hlavní části cytoskeletu jsou 3:
Hlavní organizační strukturou celého cytoskeletu je centrozom, v jehož středu se nacházejí dva centriony orientované kolmo na sebe jako senzory elektromagnetického pole. Z centrozomu vyrůstají trubičkovité mikrotubuly, které svým kladným koncem směrují k buněčné membráně. Mikrotubuly jsou velice pružné a i při působení malých sil se silně deformují.
Při růstu mikrotubulů do délky se uvolňuje energie, jejíž část zůstává uchována v cytoplazmě a část je vázána v mikrotubulech. Dynamická rovnováha je zde velice důležitá pro udržení energie v mikrotubulech a souvisí jejich růstem a případně i rozpadem.
Dva centrozomy se mohou pomocí mikrotubulů spojit, dojde k navázání kinetochorů a polárních mikrotubulů. Při tomto spojení naopak dochází ke spotřebování energie, aby zůstala zachována funkce mikrotubulů, neboť ty jsou polární.
Elektromagnetické pole vznikající při růstu mikrotubulů je možné měřit i mimo buňku, přes její membránu. Takovéto pole jediné buňky je ovšem nesmírně slabé, vůbec na hranici současné měřicí techniky. Jedním z pracovišť kde v současné době probíhá výzkum emitovaného elektromagnetického pole buňky v závislosti na období buněčného životního cykly je i Ústav radiotechniky a elektroniky Akademie Věd ČR v Praze. Zde měří elektromagnetické pole jediné buňky geneticky modifikovaného kmene kvasinek, u nějž pod teplotou 18 °C nedochází k vytváření mikrotubulů. Teprve po ohřátí buněk nad tuto kritickou teplotu začíná buněčná fáze M doprovázená hromadnou tvorbou mikrotubulů a emise elektromagnetického pole. Tato teplotní synchronizace všech buněk je nesmírně důležitá neboť není možné přesně vybrat buňku, jejíž pole se bude měřit, tato buňka je vybrána náhodnou sedimentací do vyleptaného měřicího okénka senzoru.
Celá měřicí aparatura je založena na elektrolitograficky vyrobeném senzoru, kde na křemíkové destičce jsou naneseny dva mikroskopické kontakty a kromě nich je celé okolí pokryto izolační vrstvou SiO2. Kontakty jsou připojeny na vstup širokopásmového zesilovače s extrémním vstupním odporem, který plní spíše funkci impedančního oddělení a dále je signál veden do širokopásmového videozesilovače a poté je signál zpracováván spektrálním analyzátorem. Oba zesilovače jsou z důvodu minimalizace rušení vnějším polem uzavřeny v elektrickém i magnetickém stínění spolu s bateriovým napájením. Ačkoliv se jedná o velice kvalitní zesilovače, takto naměřený a zesílený signál elektromagnetické aktivity jediné buňky se jen nepatně pohybuje nad úrovní šumu a je proto nutné používat statistické vyhodnocování naměřených výsledků. Z výsledků mnoha měření je však patrné, že naměřené hodnoty jsou statisticky významné a korelují s životními fázemi měřených buněk.